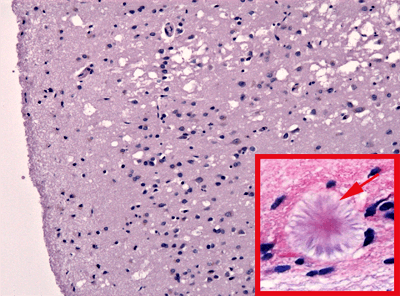
Структура нервової тканини при губкоподібній енцефалопатії. На гістологічному зрізі тканини мозку помітна «губкоподібність» – груба вакуолізація цитоплазми нейронів («порожнини»). В залежності від різновиду хвороби спостерігають різну кількість агрегатів пріонного білка – амілоїдних бляшок (позначена стрілкою), які пошкоджують нервову тканину. Масово гинуть нейрони, вакуолізуються й «бубнявіють» астроцити.
Пріонний білок характеризується унікальною структурною невизначеністю, оскільки може набувати багатьох стабільних конформацій за різних фізіологічних умов. На наш погляд, ця загадкова властивість зумовлена раптовою зміною екології в процесі еволюції, коли пріон, до того інтегральний мембранний білок, опинився в позаклітинному середовищі. Аналіз відомих пріонів хребетних виявляє початковий трансмембранний протеїн, який міститься у їхній (амінокислотній) послідовності, а це посилює гіпотезу переміщення. Очевидно, часу, що минув з моменту цієї події, було недостатньо для створення «мінімально неспроможної послідовності» в новому середовищі, ймовірно з причини функціональних обмежень, зумовлених важливістю самої гнучкості (мінливості), яка була створена у процесі переміщення. Цей сценарій може пояснити чому, у плані структури, пріонний білок і досі перебуває у процесі еволюції, прямуючи до того, щоб стати здатним до фолдингу глобулярним білком.
Трансмісивні губкоподібні енцефалопатії, або пріонні хвороби, такі як скрейпі у овець, трансмісивна губкоподібна енцефалопатія великої рогатої худоби й синдром Крейтцфельда-Якоба у людей, належать до особливого класу нейродегенеративних хвороб з унікальним патологічним механізмом. Згідно із загально прийнятою гіпотезою «тільки білок», геном хазяїна кодує білок (пріонний білок PrP), а та його форма, яка набуває неправильної третинної структури, і є відповідальною за розвиток і передачу хвороби. Існування PrP у принаймні двох, цілком відмінних один від одного станах, – природній, клітинній формі, функції якої невідомі, PrPC, і патогенній формі скрейпі (PrPSc) – не узгоджується з теорією білкового фолдингу у її нинішньому вигляді, адже вона стверджує, що глобулярні білки мають досить згладжений, воронкоподібний, ландшафт конформаційної енергії, який забезпечує їхній ефективний фолдинг, тобто набуття ними унікального, стабільного нативного стану. Множинні стабільні конформації білків у інших випадках спостерігаються тільки при амілоїдозах, класі хвороб, при яких ненормальні конформації «звичайних» глобулярних білків стабілізуються у фібрилярних агрегаціях (амілоїдах). Справді, спочатку було з’ясовано, що пріонні хвороби супроводжуються формуванням амілоїдних бляшок. На препаратах, взятих для дослідження PrPSc, за допомогою електронної мікроскопії були виявлені паличкоподібні часточки, які за морфологічним критерієм і характером забарвлювання мали властивості амілоїду, згодом такі утвори спостерігалися при деяких інших пріонних хворобах людини і тварин. Однак, згодом було встановлено, що інші форми пріонних хвороб розвиваються без утворення амілоїдних бляшок, а інфекційність препаратів скрейпі значно збільшується після обробки засобами, котрі призводять до зникнення пріонних фібрил. Фізичні методи дослідження показали, що розмір інфекційного пріону становить близько 55 кДа (тут мається на увазі димер PrP), а пріонні фібрили виявилися артефактами очищення PrPSc. Таким чином, існують різні докази для того, щоб припустити, що PrP фундаментально відрізняється від амілоїду і має характерну структурну здатність до набуття особливих конформацій без агрегації. Отже, пріонний білок є таким собі структурним ребусом, а сам факт його існування піднімає серйозні запитання.
На нашу думку, відповіді містяться в еволюційній історії пріонного білка. «Викопні рештки» трансмембранного протеїну в амінокислотних послідовностях відомого PrPSc хребетних дозволяють припустити, що він мав бути інтегральним мембранним білком, який ймовірно опинився в позаклітинному середовищі внаслідок мутації. Очевидно, ця зміна довкілля призвела до появи інших стабільних конформацій з порівнянним рівнем вільної енергії, але, з причин, котрі обговорюються у цій статті, не створила еволюційного тиску, достатнього для селекції з-поміж них лише однієї унікальної структури.
PrP видається білком мембранного походження
Для того, щоб продемонструвати, що пріонні послідовності містять рештки трансмембранного протеїну (ТП), вони були проаналізовані за допомогою чотирьох принципово відмінних методів, розроблених для прогнозування місця розташування спіралей ТП. Методи, кожен з яких має точність прогнозу понад 90%, такі: TOPPRED, DAS, PHDhtm та HMMTOP. Прогнози за цими алгоритмами були зроблені через Інтернет, з використанням відповідних серверів. Для аналізу, пріонні послідовності, подібні до послідовності людського PrP, були відібрані за допомогою методу пошуку BLAST з використанням бази даних Національного Інституту Здоров’я.
Було відібрано загалом близько 50 пріонних білків, з яких більшість дуже подібна до людської послідовності; шість з них, ідентифіковані приблизно на 90%, були використані для прогнозування. Кількість прогнозованих трансмембранних сегментів можна побачити у таблиці 1. Явно, пріонні послідовності демонструють високу схильність до мембранної локалізації: методи, головним чином, прогнозують три трансмембранні сегменти для повно розмірних послідовностей, а один чи два таких сегменти прогнозовані тільки для тих білків, для яких у базі даних міститься інформація щодо їхнього процесингу (тобто, посттрансляційних модифікацій С- та N-кінців). Для порівняння, низка трансмембранних сегментів була також передбачена для відомих глобулярних та мембранних білків шляхом використання таких само алгоритмів. Репрезентативна вибірка з 523 глобулярних білків з відомими атомними координатами була відібрана з бази даних PDB, а 158 трансмембранних білків зі встановленою мембранною топологією були відібрані вищеописаними методами. Для упевненості в тому, що прогнози є неупередженими, кожен великий структурний клас глобулярних білків належним чином представлений отак: 77 – усі а, 91 – 1b, 141 – аb, 98 – усі b, і 116 – решта.
Порівняння даних у таблиці 1 показує, що пріонний білок відрізняється від глобулярних білків. Для глобулярних білків, методи приголомшливо прогнозують повну відсутність чи наявність лише одного трансмембранного сегменту; прогноз стосовно спіралі ТП для них рідко співпадає при використанні різних методів. Щодо мембранних білків, з іншого боку, є тільки один випадок, коли зовсім не було передбачено наявності трансмембранного регіону; для 156 зі 158 білків кількість та локалізація таких регіонів радше є акуратно визначуваною. У цьому світлі, виявлення того, що жоден з шести (і, відповідно, жоден з 50) пріонних білків не мав прогнозу щодо повної відсутності трансмембранних спіралей, як виглядає, має велику прогностичну цінність. Три з чотирьох методів передбачають три такі спіралі для всіх повнорозмірних послідовностей, неодмінно, у регіонах 2 – 22, 114 – 134 та 232 – 252 (нумерація людського PrP). Хоча пріонні послідовності пов’язані, цей аналіз відносить пріонний білок до трансмембранних білків, а не до глобулярних. Є три напрямки міркувань, які підтримують значення цього дослідження.

Рис.1 Локалізація ТП спіралей у трансмембранному, глобулярному й пріонному білках. Для порівняння, 6 – 6 гомологи трьох ТП і трьох глобулярних протеїнів, які мають подібну дендрограмму до такої шести відібраних пріонних білків, були відібрані (білки подаються згідно з номером чи ID SWISS-PROT). Для кожного білка, спіралі ТП прогнозувалися за допомогою чотирьох методів і це показано відповідними кольорами: TOPPRED (зелений), DAS (червоний), PHDhtm (блакитний) і HMMTOP (жовтий). ТП регіон (визначуваний, як це подано і підписі до таблиці 2) позначений сірим, якщо прогнозувався трьома методами, й чорним, якщо чотирма. Будь-ласка, завважте, що існує тільки 11 глобулярних білків, з 523, для яких хоча б три методи прогнозували ТП регіон; тільки для трьох з них будується відносно подібна дендрограмма, як показана.
По-перше, чотири методи базуються на різних принципах, а це надає узгодженості отриманих за їх допомогою даних великого значення: TOPPRED використовує аналіз гідрофобних ділянок, вдосконалений правилом Гуннара фон Хейна («позитивний заряд -всередині»); DAS базується на тому, що амінокислотний склад трансмембранних сегментів є більш консервативним, ніж сама послідовність; метод PHDhtm базується на штучній нейронній мережі, яка побудована з використанням бази даних ТП, тоді як HMMTOP використовує приховану модель Маркова для виявлення топології максимуму подібностей для даного білка. З цих чотирьох, TOPPRED та HMMTOP базуються на апріорних принципах і не залучають статистичних параметрів; таким чином, зроблений з їх використанням прогноз не спотворюється вибором початкового набору білків.
З іншого боку, DAS та PHDhtm залучають пряме або непряме порівняння досліджуваної послідовності з відомими трансмембранними білками; таким чином, їхні результати є статистичної природи і можуть зазнавати впливу незвичної поведінки PrP, яка може дозволяти їм оминати правила, застосовувані до «нормальних» трансмембранних (і глобулярних) білків. Зважаючи на їхні відмінності, виняткове співпадіння прогнозів для всіх чотирьох методів стосовно ТП регіонів у PrP надає нашому висновку дуже сильної переконливості. По-друге, простий статистичний аналіз може бути здійснений для підрахунку ймовірності того, що даний білок правильно класифікований у плані його мембранної локалізації. Як видно з таблиці 2, шанси правильної класифікації вже є досить високими, якщо прогнозується, що білок має принаймні один трансмембранний регіон (для визначення, дивіться підпис до таблиці 2) згідно хоча б з одним з чотирьох методів. Ця ймовірність, звісно, надзвичайно зростає за умови узгодженості даних різних методів: за умови узгодженості даних усіх чотирьох, ймовірність того, що кожен даний білок є правильно класифікованим у плані належності до глобулярних чи то до трансмембранних білків є дуже високою (99,6%); це число застосовується до наших висновків, що PrP є трансмембранним білком з трьома ймовірними трансмембранними регіонами.
По-третє, ці чотири методи усі були розроблені для прогнозування ТП регіонів в інтегральних мембранних білках і ніколи не адаптувалися для розрізнення глобулярних і трансмембранних білків. Наше дослідження, однак, демонструє, що це розрізнення є, тим не менш, досяжним при використанні цих методів. Рис. 1 показує, що для кожного з гомологів обраних трансмембранних білків вони майже неодмінно прогнозують ТП спіралі там, і тільки там, де вони й справді є. На відміну, у тих рідкісних випадках відомих глобулярних протеїнів, для яких в принципі прогнозуються трансмембранні регіони, постає цілком інша картина: найчастіше даний сегмент прогнозується тільки одним методом, але не іншими; в інших випадках, він прогнозується для одного чи двох гомологів, але не для решти. Таким чином, чотири методи прогнозування разом мають значний потенціал для класифікації білків у плані їхньої трансмембранної локалізації. Навіть побіжний погляд на досконале узгодження локалізації ТП спіралей у гомологах PrP робить зрозумілим, що ці білки споріднені з трансмембранними білками, а не з глобулярними. Оскільки сьогодні PrP, за нормальних умов, є виразно естрацелюлярним білком, його переміщення з мембрани у якийсь момент еволюції видається очевидним.
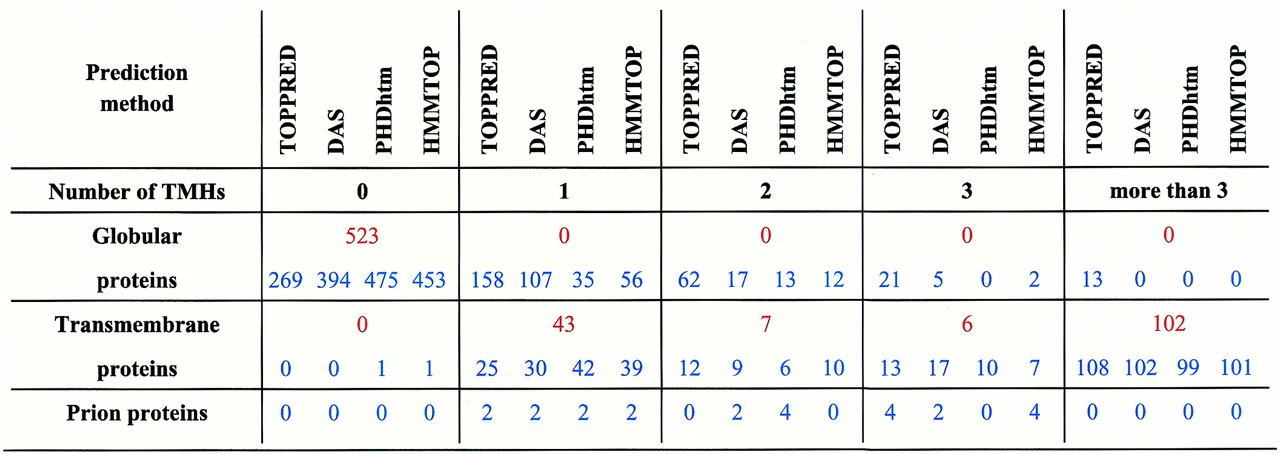
Таблиця 1 Були зроблені прогнози за допомогою чотирьох різних алгоритмів та Інтернету (використовувалися онлайн бази даних для 523 глобулярних білків та 158 трансмембранних, з відомою трансмембранною топологією, та 6 пріонних білків. Використані методи та відібрані білки описані в тексті. Для кожного структурного класу, кількість білків з даною кількістю трансмембранних спіралей показана червоним, якщо ці спіралі спостерігалися, або блакитним, якщо їх наявність тільки прогнозувалася.
Інший доказ мембранного походження PrP
Як видно, припущення, що PrP початково був інтегральним мембранним білком, краще переконує й пояснює його структурну мінливість. Є й інший доказ, який також доводить правильність цієї точки зору. Найсильніший аргумент полягає в тому, що біогенез пріонів, як видається, містить пам’ять про їхнє мембранне минуле: навіть сьогодні, PrP іноді сплутує своє клітинне призначення й поводиться як мембранний білок. Вивчення його переміщення в мембрану ендоплазматичного ретикулуму показало, що як у штучних трансляційних системах, так і в умовах in vivo він синтезується більш ніж в одній топологічній формі. Секреторна форма повністю переміщується в цистерни ЕПР і транспортується до поверхні клітини, де й розміщується за нормальних фізіологічних умов. Решта, однак, сполучається з регіоном, який розташований між залишками 113 і 135, що пронизує мембрану (цей регіон називається ТМ1), що є точною позицією другої трансмембранної спіралі, яку ми передбачили для предківської форми пріонного протеїну. Відносна кількість різних форм є дуже чутливою до мутацій чи до застосовуваної трансляційної системи, що свідчить про схильність PrP до локалізації в мембрані. Таким чином, є достатній доказ того, що PrP має інтимне й складне відношення до мембрани навіть сьогодні. Збереження ТП топології, як було передбачено, показує (Рис.1), що це може бути прадавня особливість PrP, яка, ймовірно, існувала до розходження еволюційних шляхів ссавців, птахів та рептилій. Понад те, вирівнювання усіх послідовностей PrP показує, що серединний ТП регіон (TM1) є абсолютно консервативним: відтинок з 16-ти амінокислот (113 – 128 у людському PrP) зовсім не виявляє ніяких варіацій. Останній спільний предок досліджуваних видів повинен був мати PrP з такою самою послідовністю у цьому місці, яка вказує на виражений трансмембранний характер: трансмембранне походження PrP видається певним.
Ще один доказ на користь еволюційного переміщення PrP з мембрани з’являється в результаті дослідження, проведеного з метою з’ясування топології ТП у його мембранній формі. Спочатку було зазначено, що однією з форм PrP є трансмембранний протеїн, який двічі пронизує ліпідний бішар, а обидва його кінці (С та N) локалізовані в цистерні ЕПР. Така топологія вимагає, щоб PrP пронизував мембрану не тільки своїм регіоном ТМ1 (133 – 135), але також і ТМ2, де є низхідна амфіпатія спіралі (157 – 182). Ця топологія зумовлюється прикріпленням до цистерни ЕПР С-термінального глікозит-фосфатидилінозитольного анкера, але дуже важко узгодити це з правилом «позитивний заряд – всередині», яке стверджує, що первинна детермінація орієнтації ТП спіралі полягає у різниці зарядів між її двома найближчими фланкуючими регіонами, і більш позитивно заряджена сторона має значну цитоплазматичну преференцію.
Велику доказову силу має сильна преференція до NcytoCexo (N-кінець у цитоплазмі) орієнтації ТМ1 (дивіться також Рис.2 для найбільш ймовірної топології), за якої позитивно заряджений N-термінальний фланкуючий регіон ТМ1 (ефектор зупинки трансферу (STE)) локалізовано в цитоплазмі; понад те, мембранна вставка ТМ2 не є дуже ймовірною, оскільки усі методи прогнозування знехтували нею. Зовсім недавно, справді, було виявлено, що PrP існує у двох різних ТП формах, кожна пронизує мембрану ТМ1 регіоном, але вони мають протилежну орієнтацію.

Таблиця 2 523 глобулярних і 158 трансмембранних білків було відібрано, як це описується в тексті. Трансмембранні регіони визначаються як частина послідовності, для якої сегмент з 15 залишків прогнозується неодмінно як ТП спіраль за допомогою якоїсь кількості (від 1 до 4) методів прогнозування. Для кожного випадку кількість і відсоток білків, які за прогнозами не мають (у випадку глобулярних білків) або мають (у випадку трансмембранних білків) трансмембранні регіони, ретельно підраховано. 11 глобулярних білків, які мають трансмембранні регіони згідно з принаймні 3-ма методами прогнозування, це: 1bia, 1ciy, 1din, 1frp, 1lci, 1lcp, 1oxa, 1phg, 1ytb, 2adm, and 2pia; єдиним таким білком, для якого співпав прогноз, зроблений за допомогою усіх чотирьох методів, був 1din. Загальна сума чисел сприяє тому, що відсоткова ймовірність класифікації довільно обраних білків у плані приналежності до того чи іншого класу є правильною.
Усі ці спостереження – поряд з секреторною формою та відзначеною чутливістю трансмембранних форм до трансляційних систем і зауваженням мутацій в STE та ТМ1 – є чіткими ознаками «топологічної фрустрації» PrP (тобто, того, що різні його частини детермінують конфліктуючі топології). Цей топологічний «ребус» також був відзначений в літературі. Така ситуація, що й не дивно, є дуже рідкісною для натуральних протеїнів, але може бути зумовленою запланованими мутаціями у трансмембранному білку, який неодноразово пронизує мембрану. Логічно припустити, що мутація подібної послідовності мала місце десь протягом еволюції PrP і зумовила фрустрацію трансмембранної топології структури PrP, а це чітко свідчить про глибоку й раптову еволюційну зміну.
Можлива еволюційна історія PrP
У попередніх розділах йшлося про докази раптової зміни умов довкілля протягом еволюції PrP, хоча більш спекулятивне питання стосовно того як усе це трапилося також варте уваги. Два питання, пов’язані з викладеним нижче сценарієм, будуть розглянуті глибше: (1) яка саме частина PrP зазнала мутації, котра зумовила зміну і (2) чому мутація була сприйнята й зафіксована, якщо вона мала такі явно «фрустраційні» наслідки для структури та функції PrP? Щодо точного місця мутації, то є два очевидних кандидати, але не можна виключати й інших. Є досить вагомі докази того, що клітинна локалізація PrP дуже чутлива до змін у регіоні STE-TM1.
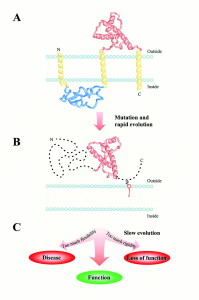
Рис.2 Загальні обриси можливої еволюційної історії пріонного білка. Припускається, що три великі стадії мали місце. (А) Пріонний білок колись був інтегральним мембранним протеїном з трьома трансмембранними спіралями. Сьогоднішній глобулярний домен (NMR структура 1B10 з бази даних PDB показана червоним) повністю розміщується у позаклітинному просторі. (В) Мутація зумовила переміщення PrP з мембрани у позаклітинний простір. Була створена фрустраційна послідовність з висячою структурою. Короткий, швидкий еволюційний дрейф у бік послідовності з мінімальною фрустрацією і глобулярною структурою розпочався. Незабаром, однак, прогрес був зупинений встановленням функції, яка покладалася на саму структурну гнучкість, яка була зумовлена переміщенням. (С) Повільний прогрес послідовності мав місце після цього, він був зумовлений потребою збалансування між надмірною гнучкістю (хвороба) та надмірною ригідністю (втрата функції) структури.
Окрім того, цей регіон видається відповідальним за інсерцію PrP в обох трансмембранних орієнтаціях, що припускаються, а також за появу секреторної форми. Оскільки ТМ1 є абсолютно консервативним, регіон STE (чи механізм транслокації, котрий з ним взаємодіє) є головним кандидатом на мутацію, яка спричинила переміщення. Далі, тим місцем, у якому чи біля якого, слід шукати, є дві термінальні трансмембранні спіралі (2 – 22 й 232 – 252 у людському PrP). Ці послідовності, як виглядає, сигналізують про ініціацію транслокації й гліколіпідизацію, відповідно, і зазвичай вони відсікаються у процесі дозрівання; але так могло бути не завжди.
Мутація, наприклад, яка створила сайт клівледжу для сигнальної пептидази на N-кінці ТП спіралі, могла призвести й до такої ситуації, яку ми вивчаємо сьогодні: втрата постійного мембранного анкера могла спотворити увесь процес біогенезу PrP. Це підкреслює – а насправді й усю схему релокалізації – той факт, що ці ТП регіони припадають саме на ті місця, на які припадають піки амінокислотної мінливості PrP. Якщо ці частини білка були інструментами стабілізації його структури в мембрані, вони неодмінно мали зазнати змін у послідовності для того, щоб звільнитися від цього обмеження й адаптуватися до нового середовища.
Незалежно від того, де саме сталася мутація, мабуть ще більша інтрига полягає в тому, чому вона була зафіксована, незважаючи на, на загал, серйозні наслідки. Найпростіша відповідь полягає в тому, щоб вважати наслідки мутації не настільки серйозними, наскільки вони ними видаються при першому погляді. Результат релокалізації і втрати PrP своєї функції, у дійсності, міг бути дуже незначним, якщо білок не виконував життєво важливої функції. Навіть сьогодні, нокаутовані за відповідним геном миші не демонструють ніякого, – або дуже помірний, – функціонального дефіциту від втрати PrP; це так само може стосуватися й еволюційної релокалізації. Не виникло еволюційного тиску, а отже, настільки видозмінений PrP не був елімінований. Понад те, фрустрація тривимірної структури і нагода перетворення PrP на смертельний патоген також могла мати дуже незначні еволюційні наслідки. Оскільки пріонні хвороби, зазвичай, мають дуже тривалий інкубаційний період, їхня спорадична поява відбувається рідко, а передача їх як інфекції також не є масовою, мутація, яка зумовила релокалізацію, могла бути подолана без того, щоб стати суб’єктом значної негативної селекції. Таким чином, мутація PrP могла бути зафіксована випадково.
Однак, можна вказати на декілька аспектів, які свідчать про позитивну селекцію, котра також долучилася до фіксації мутації. Одне цікаве міркування випливає з нинішнього погляду на різні ТП форми PrP у патогенезі. Вважається, що пріонний білок за нормальних умов повністю переміщається у цистерну ЕПР і транспортується до поверхні клітини, а звідтам він може звільнятися в результаті відтинання глікозилфосфатидилінозитольного анкера. Інтегровані з мембраною форми спостерігаються тільки у штучних трансляційних системах, у трансгенних мишах, які експресують мутантні або химерні конструкти, а також принаймні під час розвитку однієї зі спадкових пріонних хвороб людини, хворобі Герстманна – Штраусслера – Шейнкера.
Як зазначалося, PrP може бути синтезований у двох головних трансмембранних формах, а ТМ1 інтегрується в мембрану у двох протилежних напрямках. Цікаво, що експресія однієї з форм (CtmPrP, для якої ТМ1 вставляється в орієнтації NcytoCexo) в трансгенних мишах, добре корелює з нейродегенеративними змінами, які нагадують генетичну пріонну хворобу; трансмембранна форма протилежної топології, як видається, не має патологічного ефекту. Мутація A117V в GSS також зумовлює накопичення патологічних трансмембранних форм, отже вона також може бути причиною нейродегенеративних змін. Що цікаво, як це видно з Рис.2, така потенційного патологічна орієнтація прогнозована для первинного PrP. Якщо кореляція пріонного захворювання з превалюванням цієї форми є правильною, давні види з цією формою у дійсності могли бути більш схильними до пріонних хвороб, ніж сьогоднішні види, зважаючи на явище еволюційної релокалізації – ймовірність перетворення PrPC на PrPSc, мабуть, є меншою, ніж була колись. Безсумнівно, мутація, яка змусила PrP залишити мембрану, могла мати негайну еволюційну перевагу і бути швидко зафіксованою внаслідок позитивної селекції.
Ця думка може бути підтримана ще більше вивченням структури, зважаючи на те, що гнучкість структури PrP як така може мати еволюційні переваги: як зазначалося, ТМ1 є абсолютно консервативним; але він же виявляється найбільш гнучкою частиною молекули у багатьох відношеннях. Гнучкість цього регіону є очевидною зважаючи на неоднакову доступність розташованих тут епітопів для специфічних антитіл: дуже ймовірно, що саме тут відбувається перехід альфа-спіралі у бета-складчатість і це має значення для формування PrPSc; дослідження NMR показують значну невпорядкованість довкола цього регіону (41 – 43) і різні штами пріонів виявляють різні місця клівледжу у ньому. Виняткова гнучкість ТМ1 також доводиться фактом існування мініпріонів, PrP делеційних мутантів, які відповідають цьому центральному сегментові, зі здатністю до утворення PrPSc й інфекції. Така примітна структурна пластичність і сильна консервація послідовності важко узгоджуються між собою, особливо тому, що цей регіон має багато аланіну й гліцину (тобто, амінокислот, які не мають хімічної функціональності). Єдиний шлях для вирішення цієї дилеми полягає у визнанні того, що гнучкість і здатність до здійснення конформаційних змін є іманентно властивою для функції PrP; така унікальна поведінка може пояснювати селекцію, спрямовану проти мутацій, які уражують цей регіон (тобто, заміщення амінокислот у бік більш визначеної глобулярної функції).
Насправді, у недавно опублікованій статті, ми доводили, що така пластична природа його структури і самодостатнє автокаталітичне розповсюдження його альтернативних конформацій може формувати базис нормальної клітинної функції PrP: цей протеїн може становити молекулярний перемикач, який визначає фенотип і оперує функціонально по-різному, можливо, навіть маючи відношення до процесу запам’ятовування. Характерність цього сценарію набутої функціональності підкреслюється роботою пріонних перемикачів у нижчих еукаріот. У дріжджів було виявлено, що два неменделівські генетичні елементи, які успадковуються, можуть бути простежені назад аж до справжнього розповсюдження за пріонним типом змінених конформацій закодованих у хромосомах цитоплазматичних білків. Ці білки є регуляторними ефекторами функції, один з яких (Sup35) дозволяє клітинам використовувати потенційно наявні генетичні варіації для адаптації до змінюваного середовища. Структурна і функціональна аналогія цих білків і пріонів ссавців підкреслюється фізичними дослідженнями, які показують, що конкретний регіон в них може здійснювати перемикання між двома альтернативними станами й набувати стабільної пріонної конформації; цей регіон відзначається консервативністю своєї послідовності. Пріонний білок хребетних може зупинитися на півдорозі на шляху до перетворення на глобулярний білок з тієї ж самої причини.
Є ще один момент, який може допомогти збагнути яким чином відбуваються релокалізації. Можливо, коли пріонний білок був вилучений з мембрани, стався обмежений дрейф послідовності, який головним чином торкався термінальних регіонів. Ці зміни, однак, були недостатніми для того, щоб повністю переформатувати білок, оскільки зміна довкілля не була, принаймні з функціональної точки зору, аж настільки жорсткою. Оскільки білок перемістився з мембрани тільки до її зовнішньої сторони, колишній екстрацелюлярний домен, який відповідає сьогоднішній структурній частині між залишками 135 – 231, міг залишитися практично недоторканим, з тими самими структурою та функцією. Така функція/функції, можливо у сфері клітинної комунікації, впізнавання й передачі сигналів, могла пережити переміщення завдяки тому, що ліпідний анкер прив’язує білок неподалік від місця його попередньої локалізації й орієнтації. Фактом є те, що гнучкість і адаптивність структури загалом могла наділити цей домен такими здатностями, які виходять за межі його початкових функціональних лімітів. Екстрацелюлярний функціональний домен, таким чином, міг стати зародком для PrP у його прагненні до структурного й функціонального виживання, й можливого відродження.
Висновки
У сенсі структури, пріонний білок зв’язує здатні до фолдингу білки, які мають єдину конформацію з низькою енергією, і не здатні до фолдингу поліпептиди, які мають практично необмежену кількість тривимірних структур з порівнянними енергіями. На нашу думку, поява цієї структурної особливості може бути пояснена шляхом припущення, що в якийсь момент еволюції сталася радикальна зміна у клітинному середовищі цього білка. Рис.2 відображає наше припущення стосовно можливого плину й наслідків цієї еволюційної події.
Автори: П. Томпа, Г.Е. Ташнаді, М. Церзо, І. Сімон
Джерело: PNAS
Переклад з англійської: Юрій Косенко
P.S. Для ознайомлення зі списком використаної авторами літератури перейдіть за посиланням на оригінал статті.