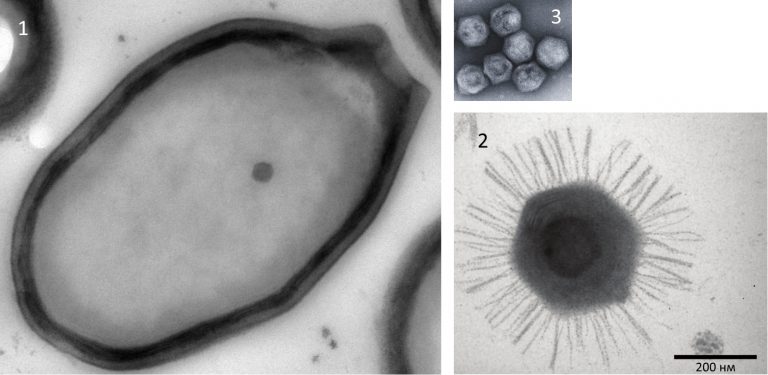
Рис. 1. Електронна мікрофографія гігантських вірусів (1 – Пандоравірус, 2 – Мімівірус) та вірофагу (3 – Мавірус). Відносні розміри вірусів збережено для наочного порівняння, масштаб подано в нижньому правому куті зображення. Зверніть увагу, що розмір вірофагу (приблизно 50 нм) відповідає стандартному ДНК вірусу.
Людина сприймає віруси однозначно як шкідників. Це твердження, звичайно, не є безпідставним, оскільки віруси здатні вести лише паразитичний спосіб життя, використовуючи ресурси клітини для свого розмноження. Але водночас такий погляд багато в чому зумовлений нашим особистим досвідом «стосунків» із вірусами. Коли, до прокладу, ми підхоплюємо грип (ортоміксовірус), нам погано: кашель, чихання, температура, сотні тисяч клітин епітелію дихальних шляхів помирають через зараження, але зрештою ми одужуємо і виганяємо шкідника зі свого організму. А тепер уявіть, що ви – одноклітинна істота. Одна клітина – це і є весь ваш організм. Як тоді будуватимуться ваші стосунки із вірусами? Виявляється, що в популяції одноклітинних евкаріотів (протистів) вірусні інфекції спричиняють цілу низку дивних феноменів, як от боротьба між вірусами, яку протисти вміло використовують на свою користь, або самопожертва однієї зараженої клітини в ім’я виживання цілої колонії.
Інтерес до епідеміології вірусних захворюваннях в одноклітинних організмах може викликати подив. Дійсно, навіщо нам вивчати віруси, які не становлять загрози безпосередньо для нас? Насправді, віруси є чи не найголовнішим рушієм популяційної динаміки протистів у світовому океані: склянка морської води містить щонайменше десять мільярдів (1010) вірусних часток. Як часто полюбляють згадувати в науково-популярній (та й в серйозній науковій) літературі, віруси – це найпоширеніша «форма життя» на Землі («форма життя» в лапках, оскільки чи віруси живі – ще досі відкрите питання – авт.). І якщо скласти докупи усі віріони на планеті, то, незважаючи на їхній наноскопічний розмір, їхня сукупна довжина сягне кількох світлових років. Тож, одноклітинні істоти буквально плавають в океані вірусів. Провокуючи масову загибель одноклітинних водоростей та динофлагелят в океані під час «глобальних пандемій», віруси втручаються у колообіг вуглецю, що має безпосередній вплив на геології та екологію Землі (гіпотеза представлена в оглядовій статті Villain, A., et. al., 2016). Тому цими малими молекулярними паразитами не можна нехтувати.
Найбільші віруси, відомі науці на даних момент – так звані гігантські віруси (giant viruses, giruses) –, описані саме в мікроскопічних одноклітинних евкаріотах. Чи це своєрідна іронія долі, чи біологічно зумовлена необхідність – покаже час і ретельні дослідження. Так наприклад, віруси сімейства Phycodnaviridae, які інфікують різноманітні мікроскопічні водорості (зелені, бурі та гаптофітові), мають віріон діаметром до 220 нм (в 2-4 рази більші за звичайні віруси) та ДНК геноми до півмільйона пар нуклеотидів (в 5-10 разів більші за решту ДНК вірусів). Але навіть вони здаються коротунами в порівнянні із вірусами амеб, такими як Мімівірус (400 нм, 1,2 мільйона п.н.) або Пандоравірус (1000 х 500 нм, 2,5 мільйона п.н.), чиї габарити наближаються до цілком пристойних бактерій, а геноми за розміром навіть перевищують їх. Взагалі, гігантські віруси водоростей та амеб вартують окремого огляду. Наразі слід відзначити дві речі. По-перше, інфікування гігантським вірусом в 99 % випадків є летальним для одноклітинного організму і протікає у три фази:
1. фаза затемнення (коли вірус наче зникає і нічого не відбувається),
2. утворення вірусної фабрики (відсіку клітини, де відбувається збірка нових віріонів — цей процес характеризується активізацією експресії вірусних генів і повним перемиканням клітинного метаболізму на побудову вірусних часток),
3. руйнування клітини і вихід віріонів, здатних заражати нові клітини.
По-друге, часто-густо гігантські віруси супроводжуються меншими вірусами, так званими вірусими-супутникими, які не можуть пройти повний цикл розмноження самостійно і користуються ресурсом фабрики гігантських вірусів. Надалі ми загостримо увагу на взаємодіях в трикутнику протист<->гігантський вірус<->вірус-супутник, і побачимо як маленькі віруси заважають жити великим.
Перший вірус-супутник був описаний у 2008 році французькою дослідницькою групою (La Scola, B., Raoult, D.) і названий просто і зрозуміло — Sputnik virus. Він був виділений з одноклітинної амеби Acanthamoeba castellanii. Подальші дослідження виявили, що Sputnik не був самостійним вірусом і потребував допомоги гігантського Мамавірусу, який також інфікував акантамебу (Acanthamoeba castellanii mamavirus — ACMV). Але цікавішою знахідкою виявилося те, що Sputnik заважав розмноженню ACMV, насамперед порушуючи формування віріонів останнього, в результаті чого вірусні частки ACMV були нездатними до подальшого інфікування клітин акантамеби. Тобто, фактично, Sputnik паразитує на вірусних фабриках ACMV, завдаючи йому шкоди. До цього феномен вірусів-супутників, чия реплікація залежить від допоміжних вірусів, був широко відомий, однак жоден з описаних раніше супутників не заважав реплікації, власне, основного вірусу. За таку поведінку Sputnik вірус назвали вірофагом (той, що поїдає віруси) за аналогією із бактеріофагами — вірусами бактерій. Отже, шановні кмітливі і допитливі розумники, віруси вірусів таки існують, з 2008 року — офіційно!
Стаття про другий вірус-супутник (або вірофаг, як їх почали називати вчені) була опублікована в квітні 2011 року. Відтак, Fischer, M.G. та Suttle, C.A. описували новий тип вірофагу, що паразитував на гігантському вірусі, який в свою чергу інфікував одноклітинного джгутиконосця з групи Страменопілів, Cafeteria roenbergensis (назва гігантського вірусу витікає з назви його хазяїна, Cafeteria roenbergensis virus — CroV). Новий вірофаг (названий дослідниками Mavirus, пояснення див. нижче) та Sputnik поділяли спільні риси будови віріонів та геномів і навіть мали щонайменше чотири гомологічні гени, включаючи капсид — основний будівельний блок віріону. До того ж, Mavirus, подібно до Sputnik, пригнічував розмноження відповідного гігантського вірусу (в даному разі – CroV). Та найвизначніша знахідка (за яку, очевидно, статтю опублікували не деінде, а в журналі Sciece) полягала саме в унікальній рисі — новознайдений вірофаг був явно споріднений із особливим класом ДНК транспозонів під назвою Maverick/Polinton. Зокрема, Mavirus мав ген інтегрази, гомологічний до такого в Maverick/Polinton, і це означало, що вірус мав здатність вбудовуватися у геном іншого організму (назва ферменту – від англ. itegrate – вбудовуватися). Транспозони, схожі на вірусів тим, що вони також – егоїстичні генетичні елементи, проте на відміну від останніх не мають капсидних оболонок і не здатні «стрибати» між клітинами. Натомість справою їхнього життя є відбудуватися в геном клітини-хазяїна і передаватися пасивно разом із поділом клітини. Біологи вже давно мали підозри щодо родинних зв’язків між ДНК транспозонами та ДНК вірусами, але ніде раніше вони не були настільки очевидні як між вірофагом і Maverick/Polinton. З огляду на це новий вірус-супутник назвали Mavirus (від Maverick virus). Залишалося лише одна принципова проблема – довести, що вірофаг дійсно має здатен до інтеграції.
Протягом наступних років з’явилися два повідомлення про вбудовування вірофагу. В 2012 році (Desnuesa, C., et.al.) було описано новий вірофаг, Sputnik 2, і зафіксовано його інтеграцію у гігантський вірус (Lentille virus), що інфікує акантамебу. На жаль, в геномі самої акантамеби Sputnik 2 не знайшли. В 2015 році (Blanca, G., et.al.) в PNAS з’явилося повідомлення про присутність численних копій вірофагу, схожого на Sputnik, в одноклітинний хлорарахніофітовій водорості Bigelowiella natans. Цього разу складність полягала у тому, що науці не був відомий жодний гігантський вірус, який би інфікував B. natans. Тоді автори дослідження зробили висновок, що наявність послідовностей вірофагів у клітинній ДНК свідчить, що водорість скоріше за все стикалася з гігантським вірусом в минулому, хоча експериментально підтвердити свої міркування вони змоги не мали. Таким чином феномен вбудовування вірофагів з розряду чисто гіпотетичного перейшов у фактично доведений. Щоправда, незважаючи на помітний поступ, розуміння біології вірофагів залишалося фрагментарним.
Остаточну крапку в дискусії щодо життєвого циклу вірофагів і їхній ролі у популяційній динаміці протистів поставило елегантне дослідження, що було проведене Fischer, G. та Hackl, T. та опубліковане нещодавно в журналі Nature. Вони виконали низку експериментів на робочій системі «джгутиконосець C. roenbergensis» <-> «гігантський вірус CroV» <-> «вірофаг Mavirus». Перший експеримент полягав в отриманні чистої культури джгутиконосця із вбудованим вірофагом. Для цього науковці інфікували C. roenbergensis одночасно вірусами CroV та Mavirus. Клітини, що пережили інфекцію, очищалися від залишків вірусів та перевірялися на наявність інтегрованого Mavirus. Їм знадобилося чимало повторів, щоб отримати бажаний результат, але зрештою вони знайшли одну потрібну клітину і вивели з неї клональну лінію. Далі за допомогою глибокого секвенування на двох платформах (Illumina та PacBio) було встановлено, що вбудовування вірофагу відбулося в одинадцяти різних місцях геному C. roenbergensis. В ході подальших експериментів дослідники встановили, що гени вбудованого Mavirus експресуються лише за умови суперінфекції із CroV. Тобто, за відсутності гігантського вірусу, вірофаг ніяк не проявляє себе в клітині. Проте, коли джгутиконосця із вбудованим вірофагом інфікує CroV, Mavirus «прокидається». Реактивація відбувається на пізній стадії інфекції, коли CroV вже побудував вірусні фабрики для виготовлення віріонів. Відповідно, Mavirus «експропріює частину потужностей» для утворення власних вірусних часток. В цій грі вірусів наввипередки клітина приречена на смерть. Однак подальше розповсюдження гігантського вірусу в популяції C. roenbergensis гальмується у присутності вірофагу, причому спостерігався чіткий дозо-залежний ефект: чим більше Mavirus – тим менше CroV. Також автори дослідження помітили, що антагонізм вірусів призводив до виживання більшої кількості клітин джгутиконосця порівняно із інфекцією самим лише гігантським вірусом. Таким чином одна клітина, яка несла в своєму геномі інтегрований вірофаг, захищала цілу колонію ціною власного життя.
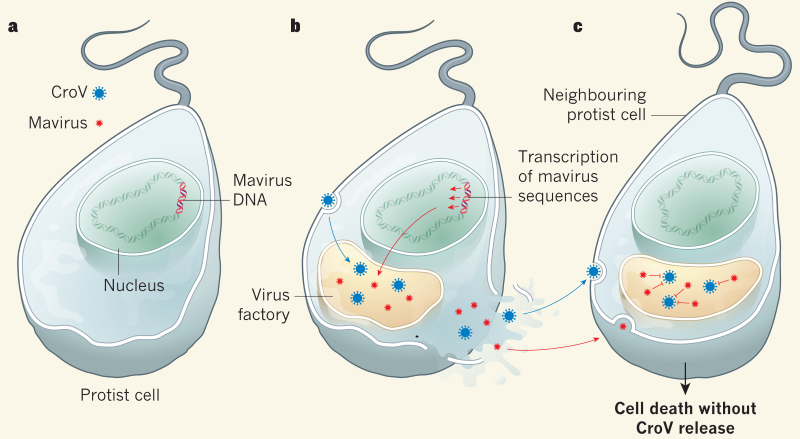
Вивчення гігантських вірусів та їх вірофагів висвітлило ще один бік неохопного і строкатого віросвіту. Чи можемо ми стверджувати, що Mavirus – ситуативний союзник джгутиконосця в боротьбі із CroV? Чи можна казати про альтруїстичну поведінку клітини C. roenbergensis, яка жертвує собою, щоб вивільнити інтегрований вірофаг і врятувати своїх братів і сестер? На мою думку, відповідь залежатиме від особистої інтерпретації кожного. Зрештою, клітина для вірусу – це лише середовище існування. З цієї точки зору реактивація вірофагу під час суперінфекції – не акт допомоги, а лише стратегія виживання. Так само й інтеграція вірофагу – не продуманий заздалегідь хід джгутиконосця із наміром захистити свою родину від гігантського вірусу, а всього лише підсумок популяційного процесу. Та незалежно від нашого ставлення до них, малі і ще менші віруси тихо роблять свої справи, результати яких мають далекосяжні глобальні наслідки.
Даниїл Грибчук для Моєї Науки
P.S. В наступній частині буде більше про причини схожості між транспозонами та вірофагами, а також про походження вірофагів. Тож, запрошуються всі, хто полюбляє еволюційні сценарії!
________________________________________
• Villain, Adrien; Gallot-Lavallée, Lucie; Blanc, Guillaume; Maumus, Florian (2016). Giant viruses at the core of microscopic wars with global impacts. Current Opinion in Virology 17. с. 130–137. doi:10.1016/j.coviro.2016.03.007
• La Scola, Bernard; Desnues, Christelle; Pagnier, Isabelle; Robert, Catherine; Barrassi, Lina; Fournous, Ghislain; Merchat, Michèle; Suzan-Monti, Marie; Forterre, Patrick; Koonin, Eugene; Raoult, Didier (2008). The virophage as a unique parasite of the giant mimivirus. Nature 455 (7209). с. 100–104. doi:10.1038/nature07218.
• Fischer, M. G.; Suttle, C. A. (2011). “A Virophage at the Origin of Large DNA Transposons”. Science. 332 (6026): 231–234. doi:10.1126/science.1199412.
• Desnues, C.; La Scola, B.; Yutin, N.; Fournous, G.; Robert, C.; Azza, S.; Jardot, P.; Monteil, S.; Campocasso, A.; Koonin, E. V.; Raoult, D. (2012). Provirophages and transpovirons as the diverse mobilome of giant viruses. Proceedings of the National Academy of Sciences 109 (44). с. 18078–18083. doi:10.1073/pnas.1208835109.
• Parkinson, John; Gaia, Morgan; Pagnier, Isabelle; Campocasso, Angélique; Fournous, Ghislain; Raoult, Didier; La Scola, Bernard (2013). Broad Spectrum of Mimiviridae Virophage Allows Its Isolation Using a Mimivirus Reporter. PLoS ONE 8 (4). с. e61912. doi:10.1371/journal.pone.0061912.
• Fischer, Matthias G.; Hackl, Thomas (2016). Host genome integration and giant virus-induced reactivation of the virophage mavirus. Nature 540 (7632). с. 288–291. doi:10.1038/nature20593.
http://my.science.ua/virusni-vijny-abo-na-yaki-virusy-hvoriyut-vlasne-virusy/