 До родини Enterobacteriaceae належать грам-негативні факультативні анаеробні паличкоподібні бактерії, які можуть викликати ряд захворювань людини, птахів, тварин та риб, таких як бактеріємія, інфекційний артрит, ендокардит, остеомієліт, інфекції нижньої частини тракту, інфекції шкіри та м’яких тканин, інфекції сечовивідних шляхів, внутрішньочеревні інфекції та офтальмологічні. Кожного року мільйони людей помирають через захворювання, які викликають представники родини Enterobacteriaceae. Також збудники даної родини призводять до великих економічних збитків. Ліки – ось раціональний та ефективний шлях контролю інфекцій, які викликають представники родини Enterobacteriaceae. Однак, через надлишок антибіотиків збільшилась резистентність, та, як наслідок, зросла кількість інфекцій, які викликає родина Enterobacteriaceae. Саме тому виникла необхідність у винайденні нових заходів контролю над інфекціями. Терапія на основі бактеріофагів – нова альтернатива антибіотикам, адже вона має інший антибактеріальний механізм. У статті узагальнено історію бактеріофагової терапії, бактеріальні механізми лізису та дослідження представників родини Enterobacteriaceae та бактеріофагової терапії.
До родини Enterobacteriaceae належать грам-негативні факультативні анаеробні паличкоподібні бактерії, які можуть викликати ряд захворювань людини, птахів, тварин та риб, таких як бактеріємія, інфекційний артрит, ендокардит, остеомієліт, інфекції нижньої частини тракту, інфекції шкіри та м’яких тканин, інфекції сечовивідних шляхів, внутрішньочеревні інфекції та офтальмологічні. Кожного року мільйони людей помирають через захворювання, які викликають представники родини Enterobacteriaceae. Також збудники даної родини призводять до великих економічних збитків. Ліки – ось раціональний та ефективний шлях контролю інфекцій, які викликають представники родини Enterobacteriaceae. Однак, через надлишок антибіотиків збільшилась резистентність, та, як наслідок, зросла кількість інфекцій, які викликає родина Enterobacteriaceae. Саме тому виникла необхідність у винайденні нових заходів контролю над інфекціями. Терапія на основі бактеріофагів – нова альтернатива антибіотикам, адже вона має інший антибактеріальний механізм. У статті узагальнено історію бактеріофагової терапії, бактеріальні механізми лізису та дослідження представників родини Enterobacteriaceae та бактеріофагової терапії.
Ключові слова: бактеріофагова терапія; антибіотики; бактеріолітичний механізм; Enterobacteriaceae.
Вступ
До родини Enterobacteriaceae належать грам-негативні бактерії. Представники даної родини є причиною захворювань кров’яного русла, запалення жовчних проток, запалення очеревини та ряд інших внутрішніх захворювань організму (Paterson, 2006). На доданок, Escherichia coli є частою причиною захворювань сечовивідних шляхів; Klebsiella pneumoniae вважається основною причиною виникнення пневмонії; Salmonella enterica прискорює розвиток гастроентериту, та, як наслідок, інвазивні захворювання у деяких пацієнтів; штам бактерій Shigella може викликати бактеріальний дисбактеріоз (шигельоз), який найчастіше протікає в епідемічній формі та стає причиною значного відсотку захворюваності та летальних результатів (Donnenberg, 2002; Paterson, 2006; Phalipon and Sansonetti, 2007; Verma et al., 2010). На жаль, серйозною проблемою контролю ентеробактеріальних інфекцій є виникнення резистентності штамів до ліків та загроза щодо створення пан-резистентних штамів (Falagas et al., 2010). Саме тому існує гостра необхідність в тому, щоб знайти альтернативний шлях для контролю ентеробактеріальних інфекцій, і одним з цих шляхів є бактеріофагова терапія.
Бактеріофагова терапія має довгу історію, витоки якої сягають початку 20-го століття. З початку відкриття пеніциліну та інших антибіотиків, завдяки їх легкому використанню та суттєвому ефекту під час лікування бактеріальних захворювань, фактично протягом пів століття мало уваги приділялось бактеріофаговій терапії (Burrowes et al., 2011). Однак, через надлишок антибіотиків, велика кількість патогенних бактерій набула резистентності до останніх, як результат – вища загроза людському здоров’ю. В Китаї найскладніша ситуація. Кількість уражень клінічно ізольованих представників родини Enterobacteriaceae досягла 30% завдяки використанню цефалоспоринів впродовж 2002 та 2009 років; також прослідковувалось швидке зростання розробки β-лактамаз широкого спектру, особливо проти таких збудників, як E. coli (з 20.8% в 2002 до 64.9% в 2009) (Yang et al., 2010). Є три основні причини для пояснення даної ситуації: 1) надлишок антибіотиків; 2) недостатня кількість антибіотиків у зв’язку з новими антибактеріальними механізмами; 3) недостатнє фінансування для розробки нових антибіотиків (Sulakvelidze et al., 2001). Найсерйознішим є те, що розробка нових антибіотиків відбувається набагато повільніше, ніж виникнення резистентності до них, саме тому перспективи розроблення нових ліків не виглядають оптимістично. Така сувора реальність змусила вчених звернутись до бактеріофагової терапії, що в подальшому почала стрімко розвиватись (Sulakvelidze et al., 2001).
Історія бактеріофагової терапії
Історія бактеріофагової терапії розпочалась з відкриття бактеріофагів. Коротко, Hankin вперше виявив антибактеріальну активність проти холерного вібріону (Vibrio cholera) у 1896 (Hankin E, 1896). За два роки по тому, Gamaleya відкрив такий самий феномен під час дослідження Bacillus subtilis (Samsygina and Boni, 1984; Sulakvelidze et al., 2001). Twort вперше відкрив зони лізису в чашках Петрі культури Staphylococcus aureus та пояснив це як вірусну інфекцію у 1915 (Twort, 1915). У 1917 році d’Herelle довів існування терапії на основі бактеріофагів (d’Herelle, 1917). Він використовував бактеріофаги для лікування бактерій роду Shigella, ізольованих від пацієнтів з дезинтерією; дослідження він проводив у чашках Петрі з агаром та спостерігав появу так званих прозорих зон (або зон лізису). Назва ‘бактеріофаги’ також було запропоновано д’Ерелем (d’Herelle); назву було отримано складанням слів “бактерія” та “поїдати” (d’Herelle, 1917; Summers, 1999). Також д’Ерель висунув ідею того, що фаги були живими вірусами, тобто не просто “ензимами”, як вважала більшість вчених його ери. У 1919 році у Парижі було вилікувано хлопчика з дизентерією за допомогою анти-дизентерійних фагів д’Ереля. В результаті чого він одужав за декілька днів. Незабаром було вилікувано трьох пацієнтів з бактеріальною дизентерією за допомогою анти-дизентерійних фагів д’Ереля, що підтвердило ефективність бактеріофагової терапії. На жаль, ці дослідження не були завершені. У 1921 році Bruynoghe та Maisin використали бактеріофаги для лікування стафілококового захворювання шкіри (Bruynoghe and Maisin, 1921; Payne et al., 2000). У 1932 році вчені східної Європи винайшли кількість бактеріофагів, базуючись на численних тестуваннях тварин і людей. Згодом декілька організацій, таких як Parke-Davis Company та Eli Lilly and Company, розпочали активний випуск бактеріофагової продукції проти бактеріальних патогенів. В Китаї бактеріофагова терапія знайшла свій початок у 1955 році, коли Si et al. успішно застосували бактеріофаги з метою лікування Shigella dysenteriae (Si, 1955). Однак, в ранніх дослідженнях продукція на основі фагів застосовувалась щодо вузького кола хазяїв, була недостатньо гомогенізованою та не стабільною, що суттєво обмежувало її застосування (Qian et al., 2007).
Бактеріолітичний механізм
Бактеріофагова терапія – це терапія із застосуванням бактеріофагів з метою подолання патогенних бактерій. Після адсорбування на поверхні бактерій фаги починають бактеріолітичний процес. В залежності від ендолізину існують дві основні моделі механізмів лізису клітини хазяїна. Одна з моделей базується на лізоцимі, що виробляється фагами з дволанцюговою ДНК, таких як фаги К та Т4 для розщеплення бактерій; інша ж модель не потребує лізоциму, така як фаг MS2 з одноланцюговою РНК та фаг φX174 з одноланцюговою ДНК (Young, 1992). Тобто існує два основні механізми бактеріального лізису. Перший з них – лізоцим незалежна. Бактеріофаги з цим механізмом не містять генів, що кодують лізоцим, саме тому вони розщеплюють бактерії за допомогою синтезу протеїнів для інгібування в свою чергу біосинтезу бактеріальної стінки, що в результаті призводить до лізису бактеріальних клітин впродовж росту. Фаг Qβ з одноланцюговою РНК, що уражує E. coli, кодує протеїн A2 та прикріплюється до протеїну MurA, який каталізує реакцію синтезу стінки бактерій, тим самим попереджуючи каталіз шляхом перекривання фосфоенолпірувату доступ до активних сайтів (Reed et al., 2012). Фаг φX174 з дволанцюговою ДНК кодує мембранний протеїн E, який інгібує ензиматичну активність MraY та впливає на лізис клітини хазяїна (Tanaka and Clemons, 2012). MraY каталізує перший мембран-локалізований крок для синтезу попередника пептидоглікану (Tanaka and Clemons, 2012). Протягом такого типу лізису, бактеріальна стінка зазнає маленьких пошкоджень та залишає тінь або великий клітинний детрит у кінці (Young, 1992). По суті існує два бактеріолітичні механізми.
Бактеріолітичний механізм, незалежний від наявності лізоциму
У бактеріофагів такого типу відсутні гени, що кодують лізоцим, тому для інгібування розвитку клітинної стінки бактерій вони синтезують протеїни, що призводить до поступового лізису клітинної стінки впродовж росту. Одноланцюговий РНК фаг Qβ, що уражує E. coli, кодує білок A2 та прикріплюється до протеїну MurA, тобто ензиму, що каталізує синтез бактеріальної клітинної стінки, тим самим попереджуючи каталіз реакцій утворення фосфоенолпірувату та його доступу до активного сайту (Reed et al., 2012). Одноланцюговий ДНК фаг φX174 кодує мембранний протеїн E, який інгібує ензиматичну активність білку MraY та впливає на лізис клітинної стінки бактерій (Tanaka and Clemons, 2012). MraY каталізує першу мембран-локалізовану реакцію синтезу попереднику пептидоглігану (Tanaka and Clemons, 2012). Протягом такого бактеріолітичного механізму, клітинна стінка господаря зазнає ушкоджень та залишає тінь або великий клітинний детрит у кінці (Young, 1992).
Бактеріолітичний механізм, залежний від наявності лізоциму
Більшість дволанцюгових ДНК бактеріофагів кодують лізоцим для того, щоб ‘зламати’ клітинну стінку бактеріофагів. Дволанцюгові ДНК бактеріофаги належать до порядку Caudovirales та налічують приблизно 95% всіх відкритих бактеріофагів (McAuliffe et al., 2007). Такий тип бактеріофагів порушує бактеріальну стінку, продукуючи два типи лізоцимів, такі як голін і лізин. Голіни, які кодує бактеріофаг, являють собою різноманітну групу мембранних протеїнів. Голіни є активними ендолізинами, які кодує бактеріофаг, для порушення стінки бактерій та ініціації бактеріолітичної активності за принципом ‘літичного годинника’ (Young and Bläsi, 1995). Спираючись на структурні особливості Young et al. виділили три основні групи голінів: клас I, II та III (class I, II, III) (Figure 1) (Young and Bläsi, 1995). Типовим представником класу I є голін S105, що кодується геном S бактеріофага λ, складається з 105 амінокислот та формує три трансмембранні домени (transmembrane domains – TMDs) (Gründling et al., 2000). Цвіттер іонні та неіоногенні детергенти сприяють утворенню олігомерів білком S105 та ці ж олігомери утворюють кільцеподібні структури (Savva et al., 2008). Діаметр кільцеподібної структури загалом складає 23 нм, діаметр зовні мембрани – 9 нм для найбільшого кільця та всередині мембрани – 8 нм для найменшого кільця (Savva et al., 2008). Діаметр кільця 8 нм для внутрішньої мембрани достатньо великий для проходження ендолізину R бактеріофага λ крізь периплазматичний простір під час нападу на бактеріальну клітину. Дослідження показали, що мутація в амінокислоті білку S105 також могла вплинути на час початку лізису (Gründling et al., 2000).
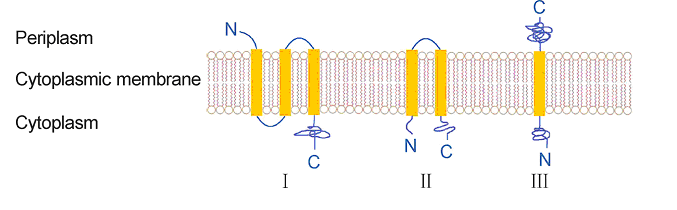
Figure 1. Топологічна структура фагових голінів. Фагові голіни поділяють на три основні групи: I, II та III.
Для II класу голінів властива наявність двох трансмембранних доменів, які зазвичай мають довжину від 65 до 95 амінокислот (Shi et al., 2012). Протеїн S21 лямбовидного фага 21 схожий на голін саме такого типу (Pang et al., 2009). На ранній стадії руйнування цитоплазми, N- та C-термінальні кінці протеїну S21 знаходяться в цитоплазмі та формують невеликі проміжки, які деполяризують мембрану. Саме через це клас II голінів також вважають пінголінами (pinholins), на противагу голінам, що формують великі проміжки (наприклад протеїни типу S105). Лізини такого типу експортуються системою секреції клітини хазяїна та акумулюють в інактивованому стані в комплексі з мембранним N-кінцем, який має властивість сигнального якоря, що вивільнюється (SAR − signal-anchor-release) та розташований в периплазматичному просторі. Деполяризація, спричинена S21, призводить до вивільнення лізину з біліпідного шару та, як наслідок, до руйнування клітинної стінки. Протягом даного процесу голін спричинює деполяризацію клітинної мембрани та призводить до вивільнення SAR лізину в біліпідний шар; саме таким чином контролюється циклічність літичного процесу (Pang et al., 2009; Xu et al., 2004).
Клас III голінів має тільки один термінальний домен, який виявляє високу гідрофобність. Прикладом може слугувати протеїн T бактеріофага T4 (Ramanculov and Young, 2001). Протеїн T бактеріофага T4 як і інші голіни має властивість викликати летальну мембранну деформацію та дозволяє лізинам прикріплюватись до бактеріальної стінки. N-термінальний кінець T протеїну знаходиться в цитоплазмі та поводить себе як мембранний деформатор; натомість C-термінальний кінець знаходиться в периплазмі та функціонує як регулятор. Більш того, протеїн T впродовж репродукційного циклу поводить себе як і інші голіни чітко запрограмованого проміжку часу (Ramanculov and Young, 2001).
Лізини відомі також як ендолізини, муралізини, мурамідази або віролізини – це перш за все високорозвинені ензими, що порушують цілісність бактеріальної стінки для вивільнення нового потомства фагів під час останньої фази розвитку літичного циклу (Fischetti, 2008). Функціонально виділяють чотири типи фагових лізинів: ендо-β-N-ацетилглюкомінідаза, N-ацетилмурамідаза, ендопептидаза та N-ацетилмурамоїл-L-аланін амідаза (Loessner, 2005; Pastagia et al., 2013). Взаємодію перерахованих лізинів з бактеріальною стінкою зображено на Figure 2. Завдяки ефективності та специфічності щодо лікарських препаратів лізини було введено в якості антибактеріальних агентів (Fischetti, 2008). Лізини повинні виконувати дві основні функції: розпізнавання субстрату та гідроліз ензимів (Díaz et al., 1990). В цілому, N-термінальний домен розрізає специфічні пептидогліканові зв’язки, натомість ендо-β-N-ацетилглюкозомінідаза та N-ацетилмурамідаза гідролізують глікозидні зв’язки в глікановому ланцюзі, ендопептидази розрізають пептидні зв’язки поперечних містків та N-ацетилмурамол-L аланін амідази розрізають амідні зв’язки, з’єднуючи функціональну групу полісахариду та пептидну основу (Pastagia et al., 2013).
Отже, ми бачимо різницю між бактеріолітичними механізмами, що залежні та незалежні від наявності лізоциму. Фаги з незалежним бактеріолітичним механізмом не продукують голіни та лізини. Фаги з таким механізмом кодують протеїни або пептиди для інактивації синтезу ензимів бактеріальною стінкою, тому функціонують такі фаги на клітинах в стадії росту; після лізису бактеріальної клітини залишається її тінь або уламки, такий механізм нерідко зустрічається серед одноланцюгових РНК та ДНК фагів. Та навпаки, фаги із залежним бактеріолітичним механізмом використовують комбінацію голінів та лізинів для порушення бактеріальної стінки на будь-якому етапі розвитку, при цьому стінка лізується повністю; такий механізм зустрічається серед дволанцюгових ДНК фагів.
Бактеріофаги мають довгу історію лікування різних бактеріальних захворювань та є альтернативою антибіотикам (Sulakvelidze et al., 2001). Нижченаведений матеріал є підсумовуванням вчення про фагову терапію родини Enterobacteriaceae.
Бактеріофагова терапія проти родини ENTEROBACTERIACEAE
Escherichia coli. За оцінками ВООЗ близько 5 млн. дітей помирає кожного року внаслідок гострої діареї (Snyder and Merson, 1982). Причиною одної третьої випадків захворювання в розвинених країнах є E. coli (Albert et al., 1995). Стійкі генетичні характерики E. coli забезпечують її широкий спектр бактеріальних захворювань (Donnenberg, 2002). Прикладом може слугувати E. coli O157, що недавно стала поширеним збудником шлунково-кишкових захворювань (Sharma et al., 2009). Більше того, не вистачає ефективної терапії захворювань, що викликає E. coli. Основа лікування – розчин для пероральної гідратації (Bhan et al., 1994). Незліченна кількість життів була врятована завдяки цому простому та дешевому заходу. Однак, це ніяк не впливає на перебіг захворювання або істинну антибактеріальну активність. Використання антибіотиків залишається сумнівним, оскільки стійкість до антибіотиків досить поширена (Savarino et al., 2002). Бактеріофаги до сих пір використовуються для лікування інфекцій спричинених E. coli.
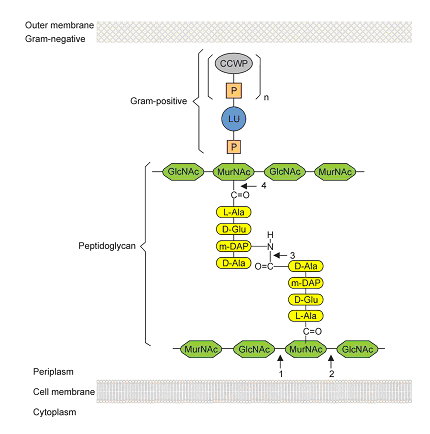
Figure 2. Лізини прикріплюються до пептидогліканової стінки бактерій (Adapted from Loessner, 2005). CCWP: carbohydrate cell wall polymer – вуглеводний полімер бактеріальної стінки; P: phosphate group – фосфатна група; LU: linkage unit – поєднання зв’язків; m-DAP: meso-diaminopimelic acid – мезодіамінопімелінова кислота; GlcNAc: N-ацетилглюкозамін; MurNAc: N-ацетилмурамінова кислота. 1: Ендо-β-N-ацетилглюкозомінідаза; 2: N-ацетилмурамідаза; 3: Ендопептидаза; 4: N-ацетилмурамоїл-L-аланінова амідаза.
Smith et al. використовували суміш фагів для лікування діареї у телят, поросят та ягнят (Smith and Huggins, 1983). Було отримано однакові результати серед різних піддослідних тварин; діарея, що була викликана ентеропатогенним штамом E. Coli , її кількість зменшилась в умовах in vivo, а також лікування дало ефект під час перебігу хвороби. Нещодавні дослідження, проведені на мишах та людях, виявили безпечність застосування фагової терапії (Denou et al., 2009; Sarker et al., 2012). Denou et al. використовув T4 коліфаг для лікування діареї, спричиненої E. Coli, шляхом комбінування тестів in vitro та in vivo (Denou et al., 2009). Було вибрано фагів на основі генетичного секвенування та біоінформатичного аналізу і знайдено, що коліфаг має значний лікувальний ефект без негативного впливу та наявності анти-T4 антитіл після 1 місяця лікування. Sarker et al. відібрали 9 фагів без горизонтального переносу генів та небажаних генів з 99 T4-подібних коліфагів, базуючись на секвенуванні з метою розробки суміші; суміш дали 15 дорослим здоровим людям з Бангладешу. В результаті не спостерігалось збільшення кількості фагів та виявлення побічних ефектів, що може також довести безпечність застосування фагової терапії (Sarker et al., 2012).
Salmonella enterica
S. enterica – бактерія, що відноситься до родини Enterobacteriaceae та може викликати сальмонельоз у людини (Paterson, 2006). S. enterica може жити в шлунково-кишковому тракті птахів та ссавців, виживати протягом довгого часу у навколишньому середовищі, наприклад, у воді, в грунті та у будь-якій їжі (Capparelli et al., 2010). Причиною більшості випадків хвороб на сальмонельоз серед людей є потрапляння у їжу тваринних фекалій. Клінічний прояв сальмонельозу серед людей має широкий прояв, починаючи від субклінічного гастроентериту і закінчуючи бактеріємією та менінгітом (Angulo et al., 2000). На сьогодні виявлено більш ніж 2300 серологічних варінтів S. enterica, які також відображають різну картину вірулентності (Heithoff et al., 2008). Через поширеність стійкості до антибіотиків серед ізолятів S. enterica доступними є тільки фторхінолони та цефалоспорини третього покоління (Angulo et al., 2000), все ж таки залишається потреба в антимікробній альтернативі. Фаг було вперше використано для вивчення та класифікації бактерії S. Enterica згідно до специфічності та серологічного варіанту (Anderson et al., 1977). Нещодавно фаги стали використовувати для контролю контамінації бактерії S. Enterica (Atterbury et al., 2007; Leverentz et al., 2001; Wall et al., 2010). Leverentz et al. використовували специфічні літичні фаги до сальмонел з метою кількості колоній в експериментально контамінованих свіжих зрізах дині та яблук (Leverentz et al., 2001). Вдалося з’ясувати, що популяція сальмонел зменшувалась під дією низьких температур в дині, але такого результату не було отримано в яблуках через низький pH. Atterbury et al. намагались зменшити популяцію сальмонел у курей бройлерів, використовуючи специфічні фаги (Atterbury et al., 2007). Було вибрано три фага з 232, що уражують сальмонел та мають широке коло хазяїв. Двоє з трьох вибраних фагів виявили ефект зменшення кількості колоній S. enterica, що знаходились у відростку сліпої кишки. Дослідження також допомогло виявити основні фактори безпосереднього контролю фагами сальмонел та оптимізації як часу, так і методу доставки фагів (Atterbury et al., 2007). Wall et al. використовували суміш фагів для лікування малих та затребуваних на ринку свиней; було показано, що в групі свиней з фаговою сумішшю суттєво зменшилась кількість сальмонел, що знаходились у клубовій кишці та відростку сліпої кишки (Wall et al., 2010).
Klebsiella pneumoniae
K. pneumoniae – це грам-негативний опортуністичний патоген, що найчастіше асоційований із захворюваннями сечовивідних шляхів, кров’яного русла, внутрішнього черева та пневмонією (Verma et al., 2010). Бактеріємія, яку викликає K. Pneumoniae, зазвичай призводить до значної захворюваності та смертності серед популяції загалом (Tsay et al., 2002). Говорячи прямо, через поширеність стійкості штамів K. pneumoniae до ряду препаратів, лікування інфекцій стало більш важким (Verma et al., 2009).
Специфічні вірулентні фаги до K. pneumoniae було вивчено для контролю інфекцій, які викликає K. pneumoniae (Verma et al., 2009; Chhibber et al., 2008). Malik et al. використовували бактеріофаг KØ1 для лікування опіків третього ступеня у миші, що були попередньо оброблені фатальною дозою K. pneumonia (Malik and Chhibber, 2009). Після лікування бактеріальне навантаження було зменшено та відмічено у кров’яному руслі, перитоніальному змиві та у тканині легень миші в порівнянні з контрольною групою. Зменшення кількості бактерій було виразно помітно в залежності від субкутанної чи інтраперитоніальної бактеріофагової терапії. Gu et al. запровадили покроковий підхід щодо виникнення стійких бактеріальних штамів відносно фагів (Gu et al., 2012). Згідно до цього підходу було взято суміш з трьох типів фагів та впроваджено для K. pneumoniae. Суміш з фагів помітно зменшувала кількість мутацій у K. pneumoniae в порівнянні з одним типом фагу, в результаті вдалось подолати бактеріємію, спричинену K. pneumoniae. Крім того, мінімальна доза фагової суміші була значно меншою, ніж однотипова фагова суміш для захисту мишей від летальної бактеріємії, спричиненої K. pneumoniae K7 інфекцією. Hung et al. лікували захворювання печінки, індуковане K. Pneumoniae, використовуючи ізолят фагу φNK5 (Hung et al., 2011). Результати свідчать про те, що одинична доза, менша за 2 × 108 БУО, виявилась ефективною. Лікування мишей через інтраперитоніальний або інтрагастріальний шлях спричиняло загибель K. Pneumoniae, як у кров’яному руслі, так і у тканинах легень, в порівнянні з контрольною групою. Дане дослідження підтвердило, що мінімальна доза фагу φNK5 є ефективним терапевтичним агентом проти захворювання печінки, що індуковане K. pneumoniae. Chhibber et al. використали фаг SS як агент на експериментальній моделі проти захворювання опосередкованого K. Pneumoniae у мишей (Chhibber et al., 2008). Одноразове внутрішньоперитоніальне введення 1010 БУО/мл фагу здійснювалось відразу після інтраназального введення 108 БУО/мл K. Pneumoniae; B5055 було достаньо для виліковування захворювання респіраторних шляхів опосередковане K. pneumoniae. Захист інфікованої миші спостерігався після інтраназального введення приготовленого протягом 3 годин фагу. Однак, лікування не було ефективне протягом 6 годин після індукції інфекції. Тому результати свідчать про те, що успіх фагової терапії залежить від часу індукції інфекції та введення фагів з метою лікування. Не дивлячись на те, що існує небагато фагів для терапії людських інфекцій, викликаних K. pneumonia, дослідження пропонує однокомпонентні та багатокомпонентні фагові суміші для потенціального лікування інфекцій викликаних K. pneumonia.
Штами Shigella
Shigella – малого розміру, інкапсульована, нерухома, грам-негативна паличкоподібна бактерія, що викликає бактеріальну дизентерію у людини. На сьогодні відомо 4 види патогенних бактерій людини роду Shigella: S. dysenteriae, S. boydii, S. sonnei and S. fl exneri (Subekti et al., 2001). Бактеріальна дизентерія (або шигельоз) є поширеним захворюванням суспільства в багатьох розвинених країнах та викликає значну захворюваність та смертність (Niyogi 2005; Phalipon and Sansonetti, 2007). Щороку шигельоз викликає 1,1 млн. смертей серед 120 млн. випадків захворювань по всьому світу (Niyogi, 2005). Shigella передається через фекально-оральний шлях, фоміти, їжу, воду, комах або безпосередньо від людини до людини. Інфекційна доза становить 100 бактеріальний клітин (Phalipon and Sansonetti, 2007). На доданок, недопустимо неврахування вторинного зараження через навколишнє середовище (Levine and Levine, 1991).
Бактеріофагова терапія шигельозу почалась у 1917 році, коли д’Ерель вперше використав фаги для розщеплення ізолятів з деяких військових пацієнтів, що мали геморагічну дизентерію (d’Herelle, 1917; Summers, 1999).
Найактивніше вивчення та впровадження фагової терапії з метою профілактики бактеріальних інфекцій проводилось з 1963 по 1964 роки в Тбілісі, Грузія (Babalova et al., 1968). Загалом, 30 769 дітей у віці від 6 місяців до 7 років приймали участь в даному експерименті. 17 044 дитині давали фаги Shigella орально, інша частина дітей не отримувала їх. Результати показали, що у групі, яка отримувала нешкідливі ліки, дизентерія збільшилась у 3,8 разів в порівнянні з тою, що приймала фаги. Експеримент дав змогу підтвердити ефективність фагової терапії штамів Shigella.
Serratia marcescens
Немовлята найчастіше всього хворіють на S. marcescens, особливо новонароджені з імунною недостатністю та малою вагою (Larson et al., 2005). Більш того, S. marcescens має високу спорідненість до ЦНС та менінгоенцефаліт або гнойне захворювання мозку, спричинене цим патогеном, має важкий неврологічний прогноз (Messerschmidt et al., 2004). Нещодавно було повідомлено про стійкість штамів S. marcescens до широкого спектру ліків в педіатрії, тому лікування бактерії за допомогою ліків стає важчим (Maragakis et al., 2008).
У 1967 році фаги використовували для інфікування S. marcescens. Iino et al. використовували широке коло фагів χ для розщеплення 20 штамів S. marcescens (Iino and Mitani, 1967). Результати свідчать про те, що фаг χ міг інфікувати тільки штами флагели, що мали специфічний рецептор до фагу. Matsushita et al. виділили два фаги, KSP90 та KSP100, з води у навколишньому середовищі, які також пов’язані з фагом T4 та phiEco32 (Matsushita et al., 2009). Автори детально вивчили фаги, а саме їх біологічні властивості, властивості ДНК, протеїни поверхні віріонів та філогенетичні зв’язки; робота показала перспективу використання фагів щодо контролю інфекції, збудником якої є S. marcescens. Denyes et al. просеквенували геном бактеріофагу η, що уражує Serratia, завдяки чому стали відомі довжина та структура геному та функціональні кодуючі послідовності (Denyes et al., 2014). Чи є ці послідовності вірулентними, залишається поки незрозумілим. Саме такий підхід щодо вивчення бактеріофагів є важливим для їх використання у терапії.
Інші штами бактерій родини Enterobacteriaceae
Окрім вищевказаних представників родини Enterobacteriaceae, також було проведено дослідження фагів, пов’язаних з іншими представниками родини, таких як Edwardsiella (Yasuike et al., 2013), Proteus (Lazareva et al., 2001), Erwinia (Born et al., 2011) та Citrobacter (Chaudhry, 2014). Перераховані роботи свідчать про практичність використання бактеріофагів в терапії бактеріальних захворювань.
Висновки
Терапія на основі бактеріофагів є одним з ефективних методів щодо контролю бактеріальних інфекцій, а також альтернативою антибіотикам у вищенаведених аспектах. Фаги здатні до підвищення специфічності до хазяїна впродовж процесу знищення бактерій, що сприяє встановленню концентрації фагів, на доданок, ціна продукції фагового агенту нижча за звичайні агенти (Abedon and Thomas-Abedon, 2010). Більшість фагів має широке коло хазяїв, що дозволяє їм розщеплювати патогенні бактерії з мінімальним порушенням нормальної мікрофлори (Gupta and Prasad, 2011). В порівнянні з фагами, більшість антибіотиків хімічної природи має широкий спектр активності, що свідчить про їх схильність до збільшення продуктивності інфекцій (Carlton, 1999).
На відміну від антибіотиків, що можуть бути токсичними, фаги можуть виявляти низький показник токсичності або не виявляти токсичність для флори та навколишнього середовища в цілому (Bentley and Bennett, 2003). Бактеріофагова терапія має певні обмеження. Перше з них – проблема безпеки. Всі фаги, що будуть використовуватись для лікування, повинні пройти доклінічні дослідження. На щастя, покращення технологій секвенування геному сприяють покращенню безпечності використання фагів в терапії. Іншою проблемою є вузьке коло хазяїв; однак, таке обмеження долається через застосування суміші з різних фагів. Черговим обмеженням є обмеженість стабільності фагового препарату; подальші дослідження повинні вирішити дану проблему. Останньою проблемою є стійкість бактерій до фагів, що складається в процесі коеволюції. З приводу останньої проблеми виникає суперечка, що зосереджується на набутті бактеріями стійкості до великої кількості фагів, як трапляється у антибіотиків. Ця проблема важлива та потребує подальшого вирішення.
Подяка
Робота підтримувалась Національною Інфраструктурою мікробіологічних ресурсів (National Infrastructure of Microbial Resources) (NIMR2014-4).
Дотримання етичних принципів
Всі автори наголошують на тому, що не мають жодних конкуруючих намірів. Стаття не містить дослідження, які пов’язані з дослідженнями на людях та тваринах.
Джерело: NCBI
Переклад з англійської: Еліана Духно